Was quakt im Teich? ¶
Eine neue Methode hilft, bedrohte Amphibien schneller und zielgerichteter zu überwachen.
In der Schweiz sind 15 der 19 Amphibienarten bedroht, ein Alarmsignal für den Artenschutz.
Um ihre Bestände und Verbreitung zu erfassen, werden Amphibien schweizweit überwacht. Doch das klassische Monitoring ist arbeitsintensiv und nicht ganz zuverlässig: Fachleute und ausgebildete Freiwillige besuchen die Teiche und zählen nur jene Tiere, die sie sehen oder hören.
Zwar lässt sich mit eDNA auch aus Wasserproben bestimmen, welche Arten vorkommen – doch bestehende Methoden wie DNA-Metabarcoding oder quantitative PCR sind teuer und aufwendig.
Wir haben eine neue Methode entwickelt: «Ampliscanning» kombiniert eDNA mit der präzisen Genanalyse mittels CRISPR-Dx.
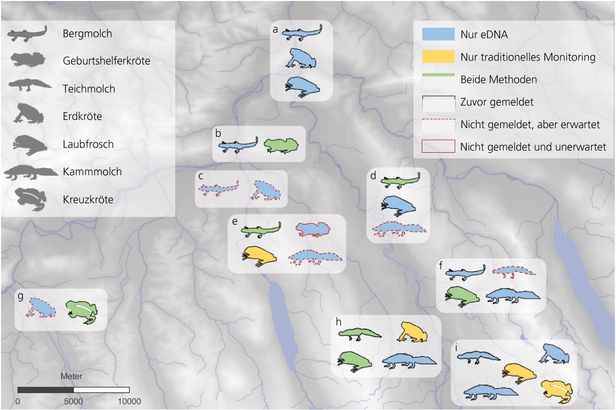
Wir haben die Methode in neun Teichen im Kanton Aargau getestet – im direkten Vergleich zur klassischen Kartierung durch Beobachtungen.
Wie erfolgreich das Ampliscanning war, zeigt diese Karte.
Bei einer einzigen Probenahme mit Ampliscanning wurden mehr Zielarten entdeckt als bei drei Besuchen mit traditionellem Monitoring.
Interessanterweise war das Ampliscanning bei schwer auffindbaren Arten wie Molchen besonders erfolgreich. Diese werden leicht übersehen, denn sie verstecken sich oft im Dickicht von Wasserpflanzen.
Dank ihres lauten Rufs wurden Laubfrösche an zwei Teichen gehört, an welchen sie nicht mit dem Ampliscanning entdeckt wurden. Da die eDNA nicht gleichmässig verteilt ist, könnte es sein, dass die beprobten Gebiete keine DNA-Spuren des Laubfrosches enthielten.
Vom scheuen Kammmolch bis zum lautstarken Laubfrosch: Diese Arten haben wir für den Vergleich untersucht. ¶







Innovation für den Artenschutz ¶
Aktuelle Methoden der eDNA-Analyse stossen an ihre Grenzen, wenn es darum geht, eine kleine Gruppe bestimmter Arten zu überwachen:
- Metabarcoding eignet sich gut, um viele Arten, die im selben Lebensraum vorkommen, gleichzeitig nachzuweisen. Es ist wie bei einem Tatort ohne Verdächtige: Die Forschenden analysieren die DNA aller Lebewesen, um herauszufinden, welche Arten anwesend waren. Doch diese Methode ist teuer, aufwendig und die Ergebnisse lassen daher lange auf sich warten.
- Die quantitative PCR (qPCR) hingegen ist spezialisiert auf den Nachweis einzelner Arten. Wie bei einem Mordverdacht sucht man gezielt nach der DNA einzelner Verdächtiger. Die qPCR ist präzis, liefert aber nur Informationen über eine Art pro Test.
Was aber, wenn man das Vorkommen einiger weniger Zielarten erfassen will? Zwischen den Extremen von qPCR und Metabarcoding klafft eine Lücke – hier setzt Ampliscanning an.